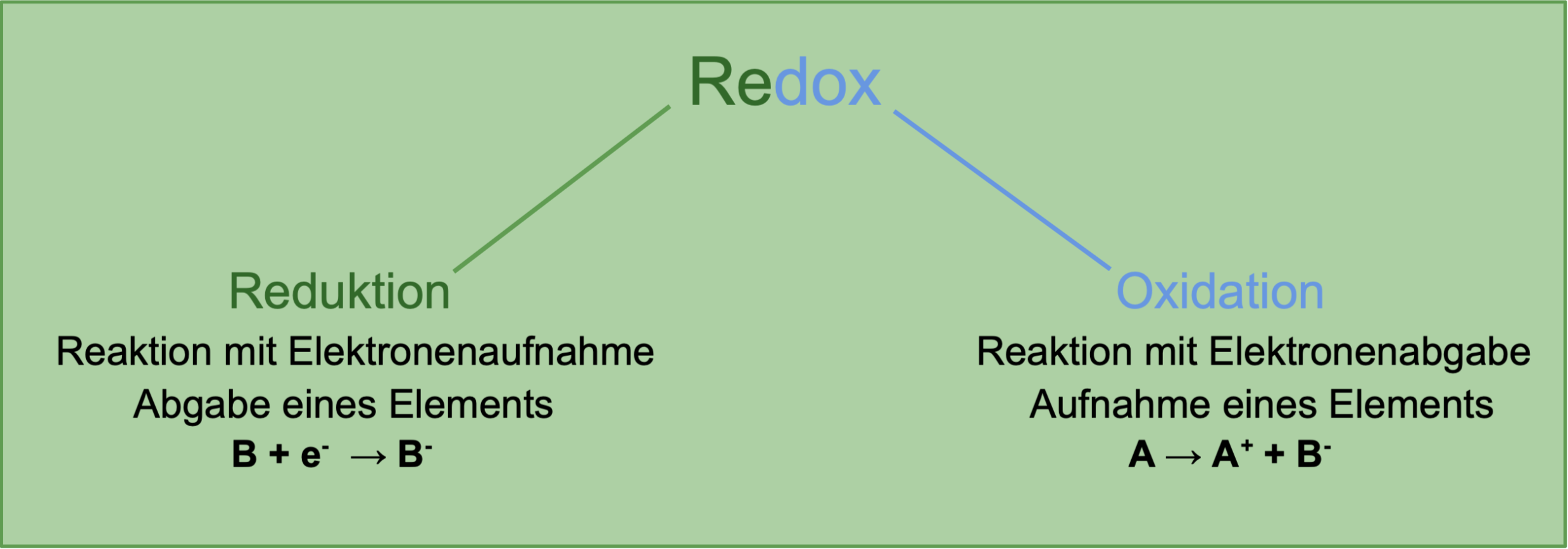
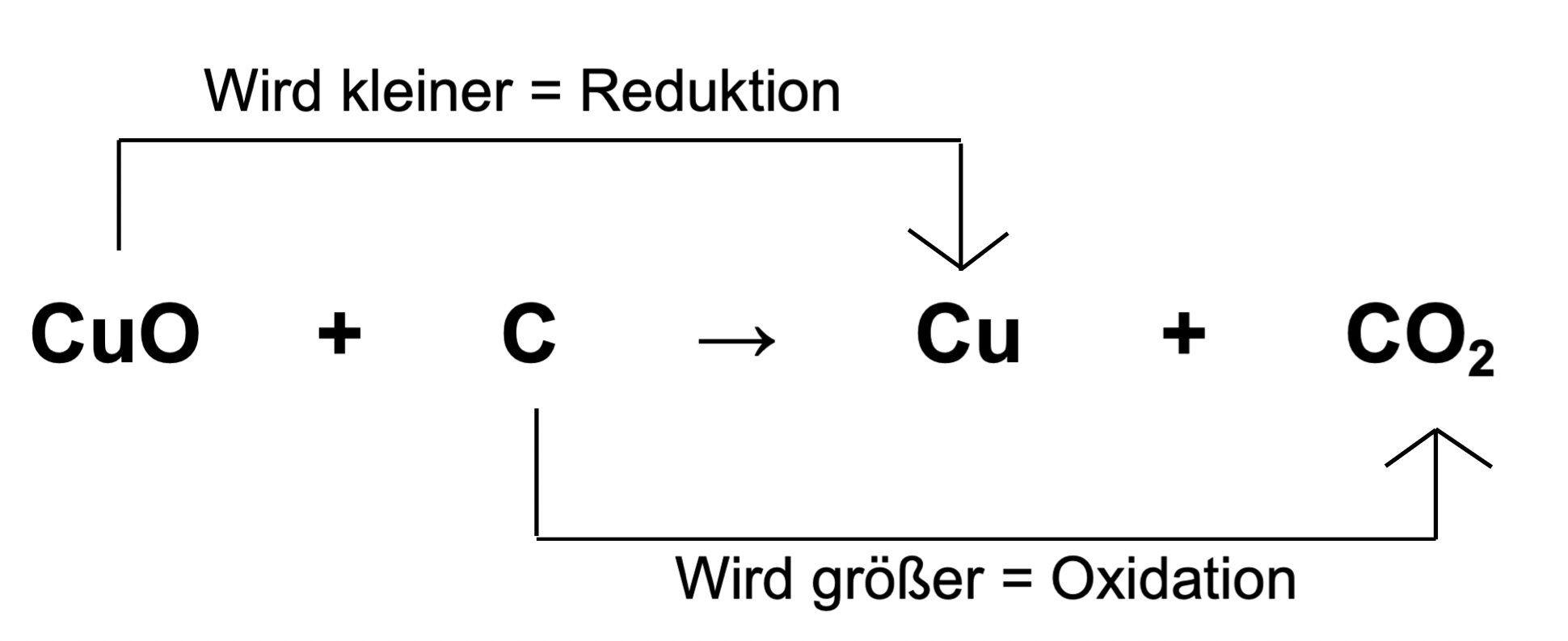
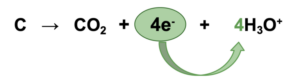
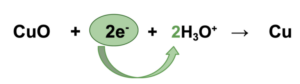
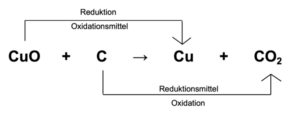
Redoxreaktionen – Beispiel
Kaliumpermanganat reagiert mit Eisensulfat im sauren Milieu zu Mangan(II)- Ionen und Eisen(III)- Ionen
MnO4¯ + Fe²+ → Mn²+ + Fe³+
1. Oxidationszahlen bestimmen
+VII -II +II +II +III
Mn O4¯ + Fe²+ → Mn²+ + Fe³+
Ladung des Ions ist durch die kleine “2+” bereits angegeben
2. Teilgleichung: Oxidation
Fe²+ → Fe³+ + e¯
Die Ladung muss in diesem Fall nicht ausgeglichen werden, da sie bereits auf beiden Seiten gleich. Dementsprechend ist auch kein Stoffausgleich nötig.
3. Teilgleichung Reduktion
MnO4¯ + 5e¯ → Mn²+
MnO4¯ + 5e¯ + 8H3O+ → Mn²+
MnO4¯ + 5e¯ + 8H3O+ → Mn²+ + 12H2O
4. Gleichung kreuzmultiplizieren
Oxidation: Fe²+ → Fe³+ + e¯ ⁄ ·5
Reduktion: MnO4¯ + 5e¯ + 8H3O+ → Mn²+ + 12H2O
5. Gleichungen zusammenfassen und kürzen:
5Fe²+ + MnO4¯ + 5e¯ + 8H3O+ → 5Fe³+ + 5e¯ + Mn²+ + 12H2O
5Fe²+ + MnO4¯. + 8H3O+ → 5Fe³+ + Mn²+ + 12H2O